Una mujer de 46 años ingresó en este hospital debido a
una hiperglucemia refractaria a la terapia con insulina.
Cinco años antes de la presentación actual, la
paciente recibió un diagnóstico de diabetes mellitus tipo 2 después de que se
desarrollaran náuseas, vómitos, poliuria y polidipsia. En ese momento, el peso
era de 113 kg y el índice de masa corporal era de 45,6. Se inició tratamiento
con metformina e insulina glargina subcutánea a dosis de 10 unidades diarias.
La paciente presentó efectos adversos asociados a metformina, por lo que se
suspendió el tratamiento con metformina y se inició glipizida. Durante los
siguientes 3,5 años, a pesar de la pérdida progresiva de peso, el control
glucémico de la paciente empeoró, lo que resultó en una intensificación gradual
de su régimen de reducción de glucosa.
Dos años antes de la presentación actual, se mudó al
área de Boston y comenzó a recibir atención en un consultorio de diabetes. El
peso era de 63 kg y el IMC de 25,4. Los medicamentos para la diabetes
incluyeron insulina glargina subcutánea (20 unidades diarias) y glipizida, y el
nivel de hemoglobina glucosilada fue del 13,2% (rango de referencia, 4,3 a
5,6). Se inició tratamiento con empagliflozina, pero se suspendió debido a una
infección del tracto urinario. Se aumentó la dosis de insulina glargina
subcutánea a 30 unidades diarias y se añadió tratamiento con insulina lispro
subcutánea, administrada a una dosis de 10 unidades tres veces al día con las
comidas. Se suspendió el tratamiento con glipizida y se inició tratamiento con
glimepirida y pioglitazona.
Un año antes de la presentación actual, el peso era de
48 kg y el IMC de 19,4. Los medicamentos para la diabetes incluyeron insulina
glargina subcutánea (34 unidades diarias), insulina lispro subcutánea (15
unidades tres veces al día con las comidas), glimepirida y pioglitazona, y el
nivel de hemoglobina glucosilada fue del 14,0%. Se había desarrollado anorexia,
junto con fatiga. Aunque la paciente afirmó haber comido muy poco, los niveles
de glucosa en sangre se mantuvieron marcadamente elevados.
Nueve meses antes de la presentación actual, el peso
era de 42 kg y el IMC de 16,9. Los medicamentos para la diabetes incluyeron
insulina glargina subcutánea (46 unidades diarias), insulina lispro subcutánea
(20 unidades tres veces al día con las comidas), glimepirida y pioglitazona, y
el nivel de hemoglobina glucosilada fue del 11,0%.
Seis meses antes de la presentación actual, desarrolló
dolor abdominal persistente y fue admitida en otro hospital. La tomografía computarizada
(TC) del abdomen y la pelvis, realizada después de la administración de
material de contraste intravenoso, no mostró evidencia de obstrucción,
perforación o absceso. El dolor abdominal se atribuyó a gastroparesia; Se
inició tratamiento con gabapentina, metoclopramida y oxicodona. Durante la hospitalización,
se encontró que la paciente tenía hiperglucemia profunda sin cetoacidosis
diabética ni síndrome de hiperglucemia hiperosmolar. El nivel de hemoglobina
glucosilada fue del 15,5%. Las pruebas fueron negativas para anticuerpos contra
la descarboxilasa del ácido glutámico, el antígeno de los islotes 2 y el
transportador de zinc 8. Se consideró un diagnóstico de lipodistrofia. Se
inició tratamiento con insulina humana regular U-500, administrada en dosis
diarias de 250 unidades con el desayuno y 200 unidades cada una con el almuerzo
y la cena. Se suspendió el tratamiento con insulina glargina subcutánea e
insulina lispro subcutánea, y fue dada de alta a su domicilio. Después de esta
hospitalización, un estudio de vaciamiento gástrico mostró un vaciado normal al
cabo de 1 hora.
Dos meses antes de la presentación actual, el dolor
abdominal empeoró y la paciente ingresó nuevamente en el otro hospital. Su
hiperglucemia fue tratada inicialmente con insulina intravenosa continua en
dosis de hasta 40 unidades por hora. Cuando el nivel de glucosa en sangre
mejoró, se suspendió el tratamiento con insulina intravenosa. Luego se reanudó
el tratamiento con insulina humana regular U-500 a una dosis mayor (550
unidades con el desayuno y el almuerzo y 450 unidades con la cena); Se inició
tratamiento con insulina isófana, también conocida como insulina protamina
neutra de Hagedorn (NPH), con una dosis de 80 unidades dos veces al día. El
dolor abdominal disminuyó con un mejor control glucémico y fue dada de alta.
En el transcurso de los 2 meses transcurridos entre el
alta hospitalaria y la presentación actual, tuvo cinco ingresos adicionales al
otro hospital debido a dolor abdominal e hiperglucemia. Durante cada ingreso,
la hiperglucemia se trató con altas dosis de insulina intravenosa, el dolor
abdominal disminuyó con una mejora de los niveles de glucosa en sangre y fue
dada de alta. Durante un ingreso, se realizó una endoscopia que reveló
gastritis erosiva y duodenitis debido a una infección por Helicobacter pylori ,
por lo que el paciente fue tratado con amoxicilina, claritromicina,
subsalicilato de bismuto y pantoprazol.
Nueve días antes de la presentación actual, el dolor
abdominal empeoró y fue trasladada en ambulancia al servicio de urgencias del
otro hospital. Se inició tratamiento con insulina intravenosa y la paciente
ingresó en el hospital. En el segundo día de hospitalización, se suspendió el
tratamiento con insulina intravenosa y se reanudó el tratamiento con insulina
humana regular U-500 a una dosis aumentada de 650 unidades cada uno con el
desayuno y el almuerzo y 600 unidades con la cena; También se reinició
tratamiento con insulina NPH a dosis de 80 unidades dos veces al día. Fue
trasladada a este hospital para recibir atención adicional.
A su llegada a este hospital, refirió dolor abdominal
epigástrico constante. También informó que había estado administrando sus
medicamentos de insulina subcutánea en casa sin omitir dosis y confirmó que
había estado rotando los lugares de inyección en su abdomen. Otros antecedentes
médicos incluyeron depresión, así como anemia y leucopenia; una biopsia de
médula ósea realizada 7 meses antes reveló fibrosis leve a moderada con
degeneración mixoide en parches. Tenía entumecimiento y hormigueo en manos y
pies que había comenzado 9 meses antes de la presentación actual. Su
menstruación había cesado 14 meses antes de la presentación actual. Otros
medicamentos incluyeron paracetamol, fluoxetina, gabapentina, glipizida,
hidromorfona, lorazepam, mirtazapina, oxicodona, pancrelipasa, pantoprazol y
pioglitazona. No tenía alergias a medicamentos conocidas. La paciente era negra
y vivía en Boston con su marido y sus hijos; Anteriormente había trabajado como
chef pero no estaba trabajando en el momento de la presentación actual. Rara
vez bebía alcohol o fumaba marihuana y nunca había fumado tabaco; ella no
consumía drogas ilícitas. Su madre tenía artritis reumatoide y diabetes tipo 2,
y su padre tenía una enfermedad hepática.
En la exploración, la temperatura temporal era de
36,1°C, la presión arterial de 108/78 mm Hg, el pulso de 98 latidos por minuto,
la frecuencia respiratoria de 16 respiraciones por minuto y la saturación de
oxígeno del 100% mientras respiraba aire ambiente. El peso era de 42 kg y el
IMC de 17,0. Presentaba caquexia con ausencia difusa de grasa corporal y masa
muscular. Su rostro tenía rasgos similares a los de la acromegalia, incluido el
ensanchamiento de la nariz y el engrosamiento de los labios ( Figura 1 ). Había
acantosis nigricans, más notablemente en el cuello y las axilas. Tenía marcas
en la piel de la cara y el cuello, y vitiligo en las orejas y en los dedos de
la mano derecha. El abdomen estaba blando, no distendido y difusamente doloroso
a la palpación, sin rebote ni defensa; no hubo hepatoesplenomegalia. Había
roturas en la piel de las piernas. El resto del examen era normal.
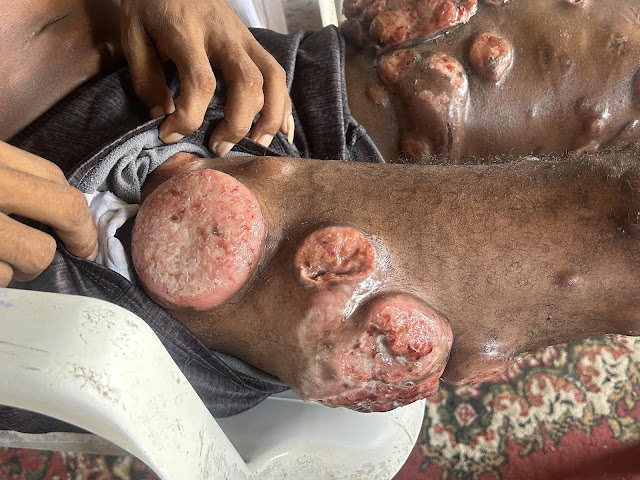
FIGURA 1 Fotografías clínicas.
Las fotografías clínicas obtenidas en el momento del
ingreso a este hospital muestran rasgos similares a la acromegalia en la cara,
incluido ensanchamiento de la nariz, engrosamiento de los labios y marcas en la
piel (Panel A); acantosis nigricans extensa que afecta el cuello y las axilas (Panel
B); y degradación de la piel, atrofia muscular y baja masa grasa en las piernas
(Panel C).
Las pruebas de laboratorio mostraron un nivel de
glucosa en sangre en ayunas de 311 mg por decilitro (17,3 mmol por litro; rango
de referencia, 70 a 100 mg por decilitro [3,9 a 5,6 mmol por litro]) y un nivel
de péptido C de 12,1 ng por mililitro (referencia rango, 1,1 a 4,4). Los
niveles sanguíneos de colesterol, triglicéridos, aspartato aminotransferasa,
alanina aminotransferasa, fosfatasa alcalina, bilirrubina total, complemento
total, C3 y C4 fueron normales. El nivel de leptina en sangre fue indetectable
y el nivel de adiponectina en sangre fue de 24,5 μg por mililitro (rango de
referencia, 2,9 a 30,4). Una prueba de detección del virus de la
inmunodeficiencia humana fue negativa. La prueba de anticuerpos contra
antígenos nucleares fue positiva con un título de 1:320 con un patrón
homogéneo; La prueba de anticuerpos contra el ADN bicatenario fue negativa. La
electroforesis de proteínas séricas mostró un patrón normal con un leve aumento
difuso en el nivel de gamma globulina. Otros resultados de pruebas de laboratorio
se muestran en la Tabla 1. Se realizaron estudios de imagen.



TABLA. Datos de laboratorio.
La tomografía computarizada del abdomen y la pelvis,
realizada sin la administración de material de contraste intravenoso, reveló
una ausencia casi completa de grasa visceral y subcutánea, con múltiples
pliegues cutáneos que reflejan una falta de grasa clínicamente significativa (
Figura 2 ). No hubo dilatación intestinal. El páncreas estaba atrófico, un
hallazgo que se observa comúnmente en pacientes con diabetes crónica
dependiente de insulina. 1 Había cálculos renales bilaterales, no obstructivos,
que medían hasta 3 mm de diámetro. El nivel de atenuación del hígado fue de 58
unidades Hounsfield (HU), lo que no es consistente con la esteatosis hepática
(que generalmente se define por un nivel de atenuación de <40 HU). 2 Se
observó una lesión hipodensa redonda, inespecífica, de 3,3 cm en la cara
superior del bazo.
FIGURA 2. TC de Abdomen y Pelvis.
La TC se realizó sin administración de material de
contraste. Una imagen axial a nivel de la pelvis media (Panel A) muestra una
ausencia casi completa de grasa visceral entre las asas del intestino no
dilatado (óvalo amarillo) y múltiples pliegues cutáneos con una ausencia casi
completa de grasa subcutánea (óvalo azul) . Una imagen axial a nivel de la
parte media del abdomen (Panel B) muestra ausencia de grasa perinéfrica
(flechas amarillas) y atrofia pancreática (flechas rojas). Una imagen axial a
nivel de la parte superior del abdomen (Panel C) muestra una lesión hipodensa
de 3,3 cm dentro del bazo (flecha) y un nivel de atenuación hepática de 58
unidades Hounsfield (HU) (óvalo).
Se realizó una prueba diagnóstica.
Diagnóstico diferencial
Esta mujer de 46 años había recibido un diagnóstico de
diabetes tipo 2 5 años antes de la presentación actual. En el tiempo
transcurrido entre el diagnóstico y la presentación actual, las dosis de
insulina exógena necesarias para reducir su nivel de glucosa en sangre
aumentaron progresivamente. Esta respuesta alterada a los medicamentos para
reducir la glucosa es consistente con la resistencia a la insulina.
La secreción fisiológica de insulina se aproxima a 0,4
a 1 unidad por kilogramo de peso corporal por día. 3 Un requerimiento de
insulina exógena superior a 2 o 3 unidades de insulina por kilogramo por día se
clasifica como resistencia grave a la insulina. 4 Al ser trasladado a este
hospital, esta paciente tenía un requerimiento de insulina sorprendentemente
alto, que excedía las 50 unidades por kilogramo por día.
PSEUDORESISTENCIA A LA INSULINA
En pacientes con sospecha de resistencia a la
insulina, primero considero posibles imitadores. La mala adherencia a la
terapia con insulina o el consumo excesivo de carbohidratos pueden enmascararse
como una sensibilidad reducida a la insulina. Además, cuando la insulina se
administra por vía subcutánea, el tejido cicatricial o el edema de los tejidos
blandos en los lugares de inyección pueden provocar una disminución de la
entrega de insulina a los tejidos periféricos. 5 Además, el uso de insulina
exógena caducada o no almacenada adecuadamente (p. ej., expuesta a la luz solar
o no refrigerada) puede reducir la eficacia. Este paciente recibió altas dosis
de insulina tanto por vía intravenosa como subcutánea mientras estaba en un
entorno hospitalario monitorizado, lo que hizo que la pseudorresistencia a la
insulina fuera un diagnóstico poco probable. Además, tenía signos y síntomas
clásicos de resistencia a la insulina que se producen debido a la reactividad
cruzada de los altos niveles circulantes de insulina con el receptor del factor
de crecimiento similar a la insulina 1 (IGF-1), incluyendo acantosis nigricans,
marcas en la piel y acromegalia. características similares ( Figura 1 ). 4
CONDICIONES FISIOLÓGICAS Y FISIOPATOLÓGICAS
La pubertad, el embarazo y la edad avanzada son
factores de riesgo asociados con la resistencia a la insulina, pero ninguno de
ellos se aplica a este paciente. La resistencia a la insulina también puede
ocurrir en asociación con condiciones fisiopatológicas, como estrés agudo (p.
ej., traumatismo o sepsis), daño de órganos terminales (p. ej., cirrosis o
uremia), aumento de peso, obesidad o inanición. 6 Esta paciente tenía obesidad
cuando recibió su diagnóstico inicial de diabetes. Sin embargo, la obesidad fue
una explicación poco probable para la presentación de esta paciente porque sus
necesidades de insulina continuaron aumentando a pesar de la profunda pérdida
de peso y eran más altas cuando su IMC estaba en el rango de bajo peso.
MEDICAMENTOS
Medicamentos específicos pueden contribuir a una menor
capacidad de respuesta al efecto hipoglucemiante de la insulina, incluidos los
glucocorticoides, los agentes antipsicóticos atípicos y la terapia
antirretroviral para la infección por el virus de la inmunodeficiencia humana.
7 Sin embargo, este paciente no recibió ninguno de estos medicamentos.
DESORDENES ENDOCRINOS
El glucagonoma, el síndrome de Cushing y la
acromegalia son trastornos endocrinos que implican hipersecreción hormonal que
puede provocar resistencia a la insulina. 6
El glucagonoma es un tumor neuroendocrino de los
islotes pancreáticos que secreta glucagón. La hiperglucemia y la pérdida de
peso son hallazgos comunes en pacientes con glucagonoma. Sin embargo, en este
caso no se observó eritema migratorio necrolítico, una erupción característica
presente en más de la mitad de los pacientes con glucagonoma. 8 Además, el
nivel plasmático de glucagón era normal.
El síndrome de Cushing se caracteriza por una
constelación de signos y síntomas asociados con la exposición prolongada a
niveles elevados de cortisol circulante, que puede ocurrir en pacientes que
reciben glucocorticoides o tienen tumores hipofisarios o suprarrenales. Sin
embargo, los hallazgos típicos asociados con el síndrome de Cushing, como
aumento de peso con adiposidad central, cara redondeada, fatiga, debilidad
muscular proximal, fácil aparición de hematomas y estrías violáceas, no
estuvieron presentes en este caso.
La acromegalia, una afección resultante de la
secreción excesiva de la hormona del crecimiento producida en la glándula
pituitaria anterior, suele ser causada por un tumor pituitario. Aunque este
paciente presentó algunos rasgos faciales consistentes con acromegalia (es
decir, ensanchamiento de la nariz y engrosamiento de los labios), no hubo
agrandamiento acral, dolor en las articulaciones, dolor de cabeza o sudoración,
todos los cuales son característicos de esta afección. Además, el nivel sérico
de IGF-1 no estaba elevado en este paciente.
Se pueden desarrollar irregularidades menstruales en
pacientes con síndrome de Cushing o acromegalia. Sin embargo, sospeché que la
amenorrea de esta paciente probablemente estaba relacionada con su bajo IMC. La
tirotoxicosis y el feocromocitoma son otros trastornos endocrinos asociados con
la resistencia a la insulina, aunque la presentación clínica de este paciente
no sugería estos diagnósticos.
SÍNDROMES LIPODISTRÓFICOS
La lipodistrofia se refiere a un grupo heterogéneo de
trastornos raros caracterizados por una falta selectiva de tejido adiposo
subcutáneo acompañada de resistencia a la insulina. 9,10 Los síndromes
lipodistróficos se pueden clasificar según el grado de deficiencia de grasa
(generalizada versus parcial) y la causa (genética versus adquirida). En casos
de lipodistrofia parcial, también pueden estar presentes áreas de
lipohipertrofia que afectan sitios como el abdomen, el cuello y el mentón. La
resistencia a la insulina se desarrolla en pacientes con lipodistrofia como
resultado de la elevación de los ácidos grasos libres circulantes y la
acumulación de grasa ectópica. Las bajas reservas de grasa también pueden
provocar niveles circulantes bajos de la adipocina leptina, lo que contribuye
aún más a la resistencia a la insulina. 9
Al evaluar a un paciente con resistencia grave a la
insulina, es importante diferenciar la lipodistrofia de la caquexia debida a
una diabetes mal controlada. 9 La insulina es una hormona anabólica y, por lo
tanto, la alteración de la señalización de la insulina en pacientes con
resistencia a la insulina puede conducir al catabolismo tanto del músculo como
de la grasa. Por el contrario, los pacientes con lipodistrofia tienen una
reducción de la grasa corporal con preservación de la masa muscular. En el
examen, este paciente tenía atrofia muscular y grasa corporal baja, hallazgos
compatibles con caquexia. Sin embargo, en pacientes con cualquiera de estas
afecciones puede producirse una falta de grasa subcutánea acompañada de un
nivel circulante bajo de leptina. Por tanto, la lipodistrofia siguió siendo una
posibilidad diagnóstica en mi evaluación de este paciente.
DEFECTOS PRIMARIOS DE SEÑALIZACIÓN DE LA INSULINA
Los defectos primarios de la señalización de la
insulina son trastornos genéticos o adquiridos raros en los que la señalización
de la insulina se altera directamente en sentido ascendente, a nivel o en
sentido descendente del receptor de insulina ( Figura 3 ).
FIGURA 3. Localización de la Resistencia a la Insulina
a Nivel Celular.
La resistencia a la insulina puede ocurrir aguas
arriba, al nivel o aguas abajo del receptor de insulina. Las características
biológicas diferenciales de cada forma de resistencia a la insulina subyacen a
su presentación clínica única. Aunque la señalización defectuosa de la insulina
ocurre en múltiples sistemas de órganos, aquí se presentan el tejido o tejidos
más destacados para distinguir cada forma de resistencia a la insulina de otras
causas. La resistencia a la insulina prerreceptora (Panel A) surge de
anticuerpos que se unen a la insulina circulante. Estos anticuerpos bloquean
transitoriamente la capacidad de la insulina para interactuar con su receptor,
lo que provoca una alteración de la absorción de glucosa por el tejido adiposo
y el músculo con la consiguiente hiperglucemia posprandial. Posteriormente, la
disociación gradual de la insulina de estos anticuerpos conduce a un efecto
retardado de la insulina sobre la captación de glucosa, lo que resulta en
hipoglucemia en ayunas. La resistencia a la insulina a nivel del receptor
(Panel B) surge de mutaciones o anticuerpos contra el receptor de insulina.
Esta forma de resistencia a la insulina se caracteriza por un deterioro global
de la señalización de la insulina aguas abajo de su receptor, de modo que la
insulina no logra suprimir la gluconeogénesis ni estimular la lipogénesis de
novo en el hígado. En consecuencia, los defectos en la señalización de la
insulina a nivel de los receptores conducen a diabetes resistente a la insulina
junto con un contenido de grasa hepática excepcionalmente normal y un nivel
normal de triglicéridos en plasma. La resistencia a la insulina a nivel de los
receptores también produce niveles circulantes altos o normales de adiponectina
y globulina fijadora de hormonas sexuales, que típicamente se suprimen por la
señalización de insulina parcialmente intacta en la resistencia a la insulina
posreceptor. La resistencia a la insulina postreceptora (Panel C), que subyace
a afecciones como la obesidad y la lipodistrofia, surge más comúnmente de la
inhibición funcional de intermediarios dentro de la cascada de señalización de
la insulina (p. ej., mediante modificación postraduccional). Más raramente, las
mutaciones que involucran la cascada de señalización de la insulina pueden
provocar esta afección. La resistencia a la insulina postreceptor se
caracteriza por un deterioro selectivo de la señalización de la insulina. En el
hígado, la insulina no logra suprimir la gluconeogénesis, pero la estimulación
de la lipogénesis de novo por altos niveles circulantes de insulina permanece
intacta. La naturaleza parcial de la resistencia a la insulina posreceptor da
lugar a una constelación de características características del síndrome
metabólico, que incluyen hiperglucemia, hipertrigliceridemia y esteatosis
hepática.
Los defectos primarios de señalización de la insulina
que ocurren aguas arriba del receptor de insulina (defectos de señalización de
la insulina prerreceptor) son causados por anticuerpos contra la insulina que
se unen a la insulina circulante. 11 Los anticuerpos contra la insulina alteran
la capacidad de la insulina para interactuar con su receptor, lo que conduce a
la hiperglucemia posprandial. La hipoglucemia en ayunas también puede ocurrir
debido a la disociación gradual de la insulina de sus anticuerpos. La acantosis
nigricans no suele desarrollarse en pacientes con anticuerpos contra la
insulina, ya que la insulina unida no produce reacción cruzada con el receptor
de IGF-1. Este paciente tenía acantosis nigricans grave sin hipoglucemia en
ayunas, lo que hacía que la resistencia a la insulina prerreceptora fuera un diagnóstico
poco probable.
Los defectos primarios de señalización de la insulina
que ocurren a nivel del receptor de insulina (defectos de señalización de la
insulina a nivel del receptor) son causados por mutaciones en el receptor o
por anticuerpos que se dirigen al receptor. 4,10 Las afecciones que afectan el
receptor de insulina pueden manifestarse en el nacimiento como síndromes
autosómicos recesivos asociados con trastornos del crecimiento y el desarrollo.
Alternativamente, las mutaciones heterocigotas u homocigotas en el receptor de
insulina pueden provocar el síndrome de resistencia a la insulina tipo A, que a
menudo se vuelve clínicamente evidente durante o después de la adolescencia. El
síndrome de resistencia a la insulina tipo B es un trastorno poco común
caracterizado por la presencia de anticuerpos contra el receptor de insulina.
Este trastorno ocurre con mayor frecuencia en mujeres negras de mediana edad
que tienen otras características autoinmunes o trastornos linfoproliferativos.
12
Los defectos primarios de señalización de insulina que
ocurren aguas abajo del receptor de insulina (defectos de señalización de
insulina postreceptor) rara vez surgen de mutaciones que involucran la cascada
de señalización de insulina. 4 Más comúnmente, la resistencia a la insulina
posreceptor es causada por la inhibición funcional de intermediarios dentro de
la vía de señalización de la insulina (como por modificación postraduccional),
que subyace a la forma clásica de resistencia a la insulina observada en pacientes
con afecciones como la obesidad y la lipodistrofia. 13,14
Las características demográficas y el perfil
autoinmune de este paciente sugerían un diagnóstico de síndrome de resistencia
a la insulina tipo B debido a anticuerpos contra el receptor de insulina. Sin
embargo, la lipodistrofia siguió siendo una consideración diagnóstica en este
caso.
DISTINGUIR EL SÍNDROME DE RESISTENCIA A LA INSULINA
TIPO B DE LA LIPODISTROFIA
En el hígado, la cascada de señalización de la
insulina se ramifica aguas abajo de su receptor para formar una vía que suprime
la gluconeogénesis y otra vía que activa la lipogénesis de novo ( Figura 3 ).
Cuando la resistencia a la insulina es causada por un defecto en la
señalización de la insulina posreceptor, como en el caso de la lipodistrofia,
la supresión de la gluconeogénesis se altera selectivamente, mientras que la
activación de la lipogénesis de novo permanece intacta. 13 La incapacidad de la
insulina para suprimir la gluconeogénesis produce hiperglucemia. Mientras
tanto, la regulación positiva de la lipogénesis de novo por altos niveles
circulantes de insulina conduce a la esteatosis hepática. En consecuencia, la
esteatosis hepática y la hipertrigliceridemia son características comunes de la
resistencia posreceptora a la insulina en pacientes con lipodistrofia. 9,15 Por
el contrario, la resistencia a la insulina a nivel de receptor, como en el caso
de la resistencia a la insulina tipo B, da como resultado un deterioro global
de la señalización de la insulina aguas abajo de su receptor. La supresión de
la gluconeogénesis y la activación de la lipogénesis de novo no ocurren en
respuesta a la insulina, lo que conduce a la rara combinación de diabetes
resistente a la insulina, contenido normal de grasa hepática y niveles
plasmáticos normales de triglicéridos. 13,15 La resistencia a la insulina a
nivel de los receptores también resulta en niveles circulantes altos o normales
de adiponectina y globulina fijadora de hormonas sexuales, que típicamente son
suprimidos por la señalización de insulina parcialmente intacta en la
resistencia a la insulina posreceptor. 16,17
Este paciente tenía un contenido normal de grasa
hepática y un nivel normal de triglicéridos, así como niveles normales altos de
adiponectina y globulina fijadora de hormonas sexuales. Estos hallazgos
hicieron improbable un diagnóstico de lipodistrofia y, en cambio, favorecieron
un diagnóstico de síndrome de resistencia a la insulina tipo B debido a
anticuerpos contra los receptores de insulina.
Diagnóstico Presuntivo
Síndrome de resistencia a la insulina tipo B.
Pruebas de diagnóstico
Las pruebas de diagnóstico para detectar anticuerpos
contra el receptor de insulina se pueden realizar mediante inmunoprecipitación
seguida de análisis de transferencia Western. En este caso, con una dilución de
suero de 1:5, hubo una fuerte señal positiva para la presencia de anticuerpos
contra el receptor de insulina ( Figura 4 ). Este hallazgo, en combinación con
la presentación clínica de este paciente, es consistente con un diagnóstico de
síndrome de resistencia a la insulina tipo B, una condición que se informó por
primera vez en 1976.18
FIGURA 4. Análisis de Western Blot.
Se añadió lisado de células CL6 que expresaban
establemente el receptor de insulina humana a una muestra de suero del paciente
además de los controles positivos y negativos. El análisis de imágenes de
transferencia Western confirmó la presencia de anticuerpos contra el receptor
de insulina en el suero del paciente. La subunidad β del receptor de insulina
se detectó a 95 kDa con el uso de inmunoprecipitación, mostrada como bandas
oscuras en los carriles para los controles positivos (+ve ctrl 1:5 y 1:50) y el
suero del paciente y como una banda tenue en el lisado solo. carril. Los
carriles estándar contenían marcadores de proteínas de un tamaño conocido. Los
carriles en blanco contenían sólo diluyente. Los carriles de control positivo
contenían suero de un paciente que había tenido un diagnóstico de síndrome de
resistencia a la insulina tipo B; el suero se diluyó en una proporción de 1:5 o
1:50 y se incubó con receptores de insulina humana recombinante. El carril de
control negativo (-ve ctrl) contenía muestras de suero de un paciente en el que
no se había encontrado síndrome de resistencia a la insulina tipo B; el suero
se diluyó en una proporción de 1:5 y se incubó con receptores de insulina
humana recombinante. El carril de solo lisado contenía lisado de células CL6
que expresaban de manera estable el receptor de insulina humana.
Hasta hace poco, no había ensayos disponibles
comercialmente para medir los anticuerpos contra los receptores de insulina.
Sin embargo, en 2023, se desarrolló un nuevo ensayo que se basó en un formato
de detección de ensayo puente, que captura anticuerpos contra el receptor de
insulina entre un receptor de insulina que contiene una etiqueta peptídica
C-terminal unida en la fase sólida y un receptor de insulina soluble con
luciferasa codificada. en su extremo C. 19 La rareza del síndrome de
resistencia a la insulina tipo B puede presentar desafíos para la
disponibilidad generalizada de un ensayo de este tipo, pero este ensayo
representa un avance potencialmente sustancial para facilitar el diagnóstico
del síndrome de resistencia a la insulina tipo B, un trastorno grave pero
tratable.
Diagnóstico de laboratorio
Síndrome de resistencia a la insulina tipo B.
Discusión de la gestión
El objetivo del tratamiento para el síndrome de
resistencia a la insulina tipo B es la remisión completa de la diabetes
resultante de la eliminación del anticuerpo del receptor de insulina.En algunos
pacientes puede ocurrir una remisión espontánea, pero el tiempo hasta la
remisión puede llevar muchos años. Cuando no se trata, el síndrome de
resistencia a la insulina tipo B se asocia con una tasa de mortalidad cercana
al 50%. 12 Debido a la rareza de esta afección, faltan datos de ensayos
controlados aleatorios sobre terapias inmunosupresoras o de agotamiento de
anticuerpos para el tratamiento del síndrome de resistencia a la insulina tipo
B. Se han probado una variedad de enfoques de tratamiento en un pequeño número
de pacientes, incluyendo plasmaféresis y recambio plasmático, 20
inmunoglobulina intravenosa, 21 y agentes inmunosupresores (p. ej., rituximab,
glucocorticoides, azatioprina, ciclofosfamida y micofenolato de mofetilo) .
12,22–25 En 2010, Malek y sus colegas informaron sobre el tratamiento exitoso
del síndrome de resistencia a la insulina tipo B en siete pacientes que
recibieron una combinación de los siguientes agentes inmunosupresores:
rituximab (un anticuerpo monoclonal anti-CD20 que se usó para atacar
anticuerpos que producen linfocitos B), terapia de pulsos con glucocorticoides
en dosis altas (utilizada para reducir la actividad de las células plasmáticas
que contienen anticuerpos) y ciclofosfamida o ciclosporina (fármacos
inespecíficos supresores de células B y T). Los pacientes fueron cambiados a
terapia de mantenimiento con azatioprina una vez que se produjo la remisión. 26
En un informe de seguimiento que involucró a 22 pacientes, este régimen
combinado condujo a la remisión (definida como mejoría de la hiperglucemia con
la interrupción del tratamiento con insulina o la normalización de la
hiperandrogenemia [o ambas]) en 19 de los pacientes después de una duración
promedio de 5 meses. . 27 Los efectos tóxicos relacionados con el uso de este
régimen combinado de agentes inmunosupresores varían según los agentes
individuales utilizados e incluyen leucopenia, mayor riesgo de infección,
disfunción gonadal y exacerbación temporal de la resistencia a la insulina por
los glucocorticoides.
La inducción de la remisión de la diabetes en
pacientes con síndrome de resistencia a la insulina tipo B suele tardar meses;
por lo tanto, el control eficaz de la diabetes mientras se espera la remisión
es un componente fundamental de la atención. Debido a la naturaleza extrema del
síndrome de resistencia a la insulina tipo B, los objetivos estándar para el
control de la glucosa en sangre en pacientes hospitalizados o ambulatorios no
son factibles. En cambio, los objetivos del control de la diabetes son revertir
el estado catabólico observado en la mayoría de los pacientes y permitir que
los pacientes sean tratados de forma segura con terapia inmunosupresora, al
tiempo que se reduce el riesgo de cetoacidosis diabética y de hipoglucemia.
La dosis mediana de insulina utilizada en la serie de
casos que incluyó a 22 pacientes con síndrome de resistencia a la insulina tipo
B fue de 1775 unidades por día; Se informaron dosis de hasta 18.000 unidades
por día. 27 En tales casos, se pueden utilizar productos de insulina
concentrada, incluida la insulina humana regular U-500, para reducir la carga
de inyección. Los anticuerpos bloquean el receptor de insulina en pacientes con
síndrome de resistencia a la insulina tipo B, por lo que la insulina no se
elimina normalmente mediante la degradación mediada por el receptor. 27 Como
resultado, tanto la insulina endógena como la exógena tienen vidas medias
circulantes prolongadas y no es posible replicar la fisiología normal de la
insulina con el uso de un régimen de insulina basal-bolo. Para reducir el
riesgo de hipoglucemia nocturna e hipoglucemia en ayunas debido a una vida
media prolongada de la insulina, la mayoría de los pacientes deben recibir las
dosis más altas de insulina por la mañana, seguidas de dosis progresivamente
más bajas a lo largo del día. En algunos pacientes se desarrolla hipoglucemia
incluso en ausencia de insulina exógena debido a los efectos agonistas de los
títulos bajos de anticuerpos en el receptor de insulina. En estos casos, el
tratamiento de la hipoglucemia generalmente implica glucocorticoides u otros
tratamientos para la inmunosupresión continua, 28 y algunas veces el
tratamiento se complementa con carbohidratos de liberación lenta (p. ej.,
almidón de maíz crudo). 29
Se realizaron pruebas adicionales en este paciente
basándose en la identificación de anticuerpos contra el receptor de insulina y
la sospecha de una enfermedad autoinmune subyacente. Las pruebas de anticuerpos
contra la ribonucleoproteína fueron muy positivas y se pensó que estos
hallazgos eran consistentes con un diagnóstico de lupus eritematoso sistémico o
enfermedad mixta del tejido conectivo. Se realizó biopsia de la lesión
esplénica, que condujo al diagnóstico de linfangioma.
Se inició tratamiento inmunomodulador con rituximab,
ciclofosfamida, glucocorticoides en pulsos e hidroxicloroquina. Se desarrolló
lesión hepática inducida por fármacos y se atribuyó a la ciclofosfamida, que se
cambió a inmunoglobulina intravenosa y azatioprina.
Desafortunadamente, después del tratamiento inicial en
este hospital, el paciente tuvo hospitalizaciones recurrentes por
complicaciones relacionadas con la inmunosupresión, incluyendo candidiasis
esofágica, colitis por Clostridium difficile y reactivación de blastomicosis
pulmonar. Estas infecciones provocaron múltiples interrupciones en su terapia
inmunomoduladora. Seis meses después del traslado inicial a este hospital,
todavía recibe altas dosis de insulina humana regular U-500, pero su peso ha
aumentado en 18 kg y el nivel de hemoglobina glucosilada ha disminuido en un
2,4%. El paciente continúa en tratamiento con agentes inmunomoduladores y está
siendo monitoreado por efectos tóxicos relacionados con el tratamiento, con el
objetivo de la remisión completa del síndrome de resistencia a la insulina tipo
B.
Diagnostico final
Síndrome de resistencia a la insulina tipo B.
Traducción de:
A 46-Year-Old Woman with Hyperglycemia Refractory to
Insulin Therapy
Authors: Lindsay T. Fourman, M.D., Leo L. Tsai, M.D.,
Ph.D., Rebecca J. Brown, M.D., and Stephen O’Rahilly, M.D.Author Info &
Affiliations
Published April 3, 2024
N Engl J Med 2024;390:1219-1229
DOI: 10.1056/NEJMcpc2312729
https://www.nejm.org/doi/full/10.1056/NEJMcpc2312729
REFERENCIAS
1. Macauley M, Percival K, Thelwall PE,
Hollingsworth KG, Taylor R. Altered vol[1]ume,
morphology and composition of the
pancreas in type 2 diabetes. PLoS One
2015;10(5):e0126825.
2. Lawrence DA, Oliva IB, Israel GM. De[1]tection
of hepatic steatosis on contrast[1]enhanced
CT images: diagnostic accuracy
of identification of areas of presumed fo[1]cal
fatty sparing. AJR Am J Roentgenol
2012;199:44-7.
3. Janež A, Guja C, Mitrakou A, et al. In[1]sulin
therapy in adults with type 1 diabe[1]tes
mellitus: a narrative review. Diabetes
Ther 2020;11:387-409.
4. Semple RK, Savage DB, Cochran EK,
Gorden P, O’Rahilly S. Genetic syndromes
of severe insulin resistance. Endocr Rev
2011;32:498-514.
5. Ariza-Andraca CR, Altamirano-Busta[1]mante
E, Frati-Munari AC, Altamirano[1]Bustamante
P, Graef-Sánchez A. Delayed
insulin absorption due to subcutaneous
edema. Arch Invest Med (Mex) 1991;22:
229-33.
6. Tritos NA, Mantzoros CS. Clinical re[1]view
97: syndromes of severe insulin re[1]sistance.
J Clin Endocrinol Metab 1998;
83:3025-30.
7. Fève B, Scheen AJ. When therapeutic
drugs lead to diabetes. Diabetologia 2022;
65:751-62.
8. Wermers RA, Fatourechi V, Wynne
AG, Kvols LK, Lloyd RV. The glucagonoma
syndrome: clinical and pathologic features
in 21 patients. Medicine (Baltimore) 1996;
75:53-63.
9. Fourman LT, Grinspoon SK. Approach
to the patient with lipodystrophy. J Clin
Endocrinol Metab 2022;107:1714-26.
10. Angelidi AM, Filippaios A, Mantzoros
CS. Severe insulin resistance syndromes.
J Clin Invest 2021;131(4):e142245.
11. Greenfield JR, Tuthill A, Soos MA, et
al. Severe insulin resistance due to anti[1]insulin
antibodies: response to plasma ex[1]change
and immunosuppressive therapy.
Diabet Med 2009;26:79-82.
12. Arioglu E, Andewelt A, Diabo C, Bell
M, Taylor SI, Gorden P. Clinical course of
the syndrome of autoantibodies to the in[1]sulin
receptor (type B insulin resistance):
a 28-year perspective. Medicine (Baltimore)
2002;81:87-100.
13. Semple RK, Sleigh A, Murgatroyd PR,
et al. Postreceptor insulin resistance con[1]tributes
to human dyslipidemia and hepatic
steatosis. J Clin Invest 2009;119:315-22.
14. Samuel VT, Shulman GI. Mechanisms
for insulin resistance: common threads
and missing links. Cell 2012;148:852-71.
15. Mann JP, Savage DB. What lipodystro[1]phies
teach us about the metabolic syn[1]drome.
J Clin Invest 2019;129:4009-21.
16. Semple RK, Soos MA, Luan J, et al.
Elevated plasma adiponectin in humans
with genetically defective insulin receptors.
J Clin Endocrinol Metab 2006;91:3219-23.
17. Semple RK, Cochran EK, Soos MA, et
al. Plasma adiponectin as a marker of in[1]sulin
receptor dysfunction: clinical utility
in severe insulin resistance. Diabetes Care
2008;31:977-9.
18. Flier JS, Kahn CR, Roth J, Bar RS. An[1]tibodies
that impair insulin receptor bind[1]ing
in an unusual diabetic syndrome with
severe insulin resistance. Science 1975;
190:63-5.
19. Minich WB, Abel BS, Schwiebert C, et
al. A novel in vitro assay correlates insulin
receptor autoantibodies with fasting in[1]sulin
in type B insulin resistance. J Clin
Endocrinol Metab 2023;108:2324-9.
20. Page KA, Dejardin S, Kahn CR, Kulkar[1]ni
RN, Herold KC, Inzucchi SE. A patient
with type B insulin resistance syndrome,
responsive to immune therapy. Nat Clin
Pract Endocrinol Metab 2007;3:835-40.
21. Zhang S, Wang G, Wang J. Type B insu[1]lin
resistance syndrome induced by systemic
lupus erythematosus and successfully
treated with intravenous immunoglobulin:
case report and systematic review. Clin
Rheumatol 2013;32:181-8.
22. Kawashiri S-Y, Kawakami A, Fujikawa
K, et al. Type B insulin resistance compli[1]cated
with systemic lupus erythematosus.
Intern Med 2010;49:487-90.
23. Coll AP, Morganstein D, Jayne D, Soos
MA, O’Rahilly S, Burke J. Successful treat[1]ment
of Type B insulin resistance in a pa[1]tient
with otherwise quiescent systemic
lupus erythematosus. Diabet Med 2005;
22:814-5.
24. Coll AP, Thomas S, Mufti GJ. Ritux[1]imab
therapy for the type B syndrome of
severe insulin resistance. N Engl J Med
2004;350:310-1.
25. Yang H, Zhao J, Li Y, Lv F, Zhang S, Li
Y. Successful treatment of type B insulin
resistance with mixed connective tissue
disease by pulse glucocorticoids and cyclo[1]phosphamide.
J Diabetes Investig 2017;
8:626-8.
26. Malek R, Chong AY, Lupsa BC, et al.
Treatment of type B insulin resistance: a
novel approach to reduce insulin receptor
autoantibodies. J Clin Endocrinol Metab
2010;95:3641-7.
27. Klubo-Gwiezdzinska J, Lange M, Co[1]chran
E, et al. Combined immunosup[1]pressive
therapy induces remission in pa[1]tients
with severe type B insulin resistance:
a prospective cohort study. Diabetes Care
2018;41:2353-60.
28. Brown N, Elston MS. Systematic re[1]view
— type B insulin resistance with iso[1]lated
hypoglycemia and suppressed insu[1]lin.
J Clin Endocrinol Metab 2023 August 8
(Epub ahead of print).
29. Censi S, Mian C, Betterle C. Insulin
autoimmune syndrome: from diagnosis
to clinical management. Ann Transl Med
2018;6:335.